Целіакія: оновлена інформація щодо епідеміології, чинників ризику, клініки, діагностики та лікування
Підготувала Ганна Гаврюшенко
Целіакія – це хронічна автоімунна ентеропатія тонкої кишки, тригером розвитку якої є вживання харчового глютену, що міститься в пшениці, ячмені та житі. Головними чинниками ризику целіакії є генетична схильність, вплив аліментарного глютену, порушення бар’єрної функції кишківника, а також уроджена схильність до прозапальної імунної відповіді. Порушення балансу мікробіому кишківника та певні інфекційні захворювання є додатковими факторами ризику целіакії. Також розвиток целіакії пов’язують із такими чинниками способу життя, як низький економічний статус і паління. Суворе дотримання безглютенової дієти (БГД) є єдиним методом лікування цього стану, що дає змогу зменшити клінічні симптоми та запобігти розвитку ускладнень у короткостроковій і довгостроковій перспективі.
У цій публікації наведено всебічний огляд оновленої інформації щодо епідеміології целіакії, чинників ризику її розвитку, клінічних проявів і діагностичних методів, а також терапевтичних стратегій, які застосовуються у веденні пацієнтів із целіакією.
Епідеміологія
Донедавна целіакія була недостатньо діагностованим захворюванням, але ширше впровадження серологічної діагностики та дуоденальної біопсії дало змогу точніше встановити частоту захворюваності та поширеність целіакії у світі [5]. У 2012 році Gujral і співавт. [6] зазначили, що приблизно 1% населення світу страждає на целіакію. Нещодавній систематичний огляд і метааналіз установив, що глобальна поширеність целіакії становить 0,7% (95% довірчий інтервал (ДІ) 0,5-0,9%) [5]. Серологічна поширеність захворювання на основі позитивних сироваткових тестів на антитіла до тканинної трансглутамінази типу 2 (анти-TG2) та/або тестів на антиендомізіальні антитіла (анти-EmA), за даними 96 досліджень, становила 1,4% (95% ДІ 1,1-1,7%) за значної гетерогенності (97,5%). Водночас глобальна поширеність підтвердженої біопсією целіакії становила 0,7% (95% ДІ 0,5-0,9%). Поширеність серед дітей була вищою, ніж серед дорослих (0,9 та 0,5% відповідно), а серед жінок – вищою, ніж серед чоловіків (0,6 та 0,4% відповідно) [5]. Чинниками збільшення ризику целіакії є наявність хворих на целіакію родичів першого ступеня спорідненості, а також інші хронічні захворювання та стани, як-от цукровий діабет 1 типу, синдром Дауна й дефіцит IgA [1, 14].
Чинники ризику целіакії
Розвиток целіакії зумовлюють генетичні чинники та вплив глютену, що стимулює автоімунні реакції, які призводять до пошкодження слизової оболонки й атрофії війок тонкого кишківника [1-3, 6, 12]. Целіакія є автоімунним захворюванням, за якого спостерігається дисбаланс між активністю Т-хелперів 1 та 2 типів. Вплив чинників спадковості й довкілля призводить до порушення функції кишківника, неадекватної імунної відповіді та дисбалансу мікробіому [1, 2].
Генетичний ризик целіакії здебільшого асоційований із певними гетеродимерами гаплотипів людського лейкоцитарного антигену (HLA) класу II, зокрема DQ2 та DQ8. Більшість пацієнтів із целіакією (близько 90%) мають позитивний HLA-DQ2, серед решти пацієнтів переважає наявність HLA-DQ8 [2]. Гомозиготність за HLA-DQ2 спричиняє вищий ризик ранньої появи захворювання в дітей [1]. Важливо зазначити, що HLA-DQ2 та HLA-DQ8 є поширеними серед населення загалом (25-35%), і лише в 3% осіб із групи ризику за HLA розвивається целіакія [1]. У більшості досліджень повідомляється, що інші варіанти HLA-DQ формують незначний ризик розвитку целіакії, оскільки вони нечасто асоціюються із цим захворюванням [1, 2, 12].
Вживання в їжу глютену та практика раннього припинення вигодовування вважаються чинниками розвитку целіакії, автоімунних реакцій і пошкодження слизової оболонки кишківника [1-3, 12]. Глютен є тригером розвитку целіакії, але на сьогодні не зрозуміло, чому не всі люди, які мають генетичну схильність, хворіють на целіакію та чому деякі випадки діагностуються в пізнішому віці [12]. Паління є ще одним чинником ризику, пов’язаним із довкіллям: у своїй публікації Snook і співавт. зазначають, що поширеність целіакії є вищою серед курців [26]. Низький економічний статус також належить до чинників ризику целіакії, оскільки він пов’язаний із низьким рівнем гігієни [27].
Одним із досліджених чинників ризику целіакії є інфекційні захворювання. За даними лонгітюдного проспективного дослідження, повторювані ротавірусні інфекції асоційовані з розвитком целіакії [21]. Отже, вакцинація проти ротавірусної інфекції може мати захисний ефект щодо розвитку целіакії [22]. Ентеровірусні інфекції в ранньому дитинстві також були асоційовані з подальшим розвитком целіакії [3, 23]. Поширеність гострих респіраторних інфекцій є важливим чинником ризику [3, 23].
Багато досліджень підтверджують наявність у мікробіомі пацієнтів із целіакією великої кількості специфічних типів мікроорганізмів, як-от бактерії родів Clostridium, Prevotella й Actinomyces, а також ротавірус і реовірус [2, 12]. Окрім того, нещодавнє дослідження показало, що мікробіом немовлят із генотипом високого ризику характеризується низькою кількістю біфідобактерій B. longus [24]. Такі особливості кишкової флори призводять до збільшення ризику автоімунних і запальних захворювань [12]. З іншого боку, деякі дослідження припускають, що певні мікроорганізми (наприклад, Helicobacter pylori або цитомегаловірус) можуть заважати розвитку целіакії, але механізм цього досі невідомий [2]. Деякі епідеміологічні дослідження досліджували вплив модулювання кишкової мікробіоти на розвиток целіакії, але докази успішності таких втручань усе ще обмежені [25].
Діагностика целіакії
До класичних клінічних ознак целіакії належать симптоми мальабсорбції, як-от хронічна діарея, рідкі пінисті випорожнення, диспепсія та здуття живота, що проявляються з раннього дитинства. М’якші поліорганні прояви целіакії можуть виникати як у дитячому, так і в дорослому віці [2, 12]. Рідкі випорожнення, біль у животі та метеоризм є найпоширенішими ознаками, хоча подеколи
не вдається виявити жодних шлунково-кишкових розладів [2]. Окрім того, існують деякі спільні клінічні симптоми серед пацієнтів із целіакією. Наприклад, 10% дорослих хворих на целіакію страждають
на герпетиформний дерматит, а ще одним поширеним явищем є залізодефіцитна анемія [2, 8, 12, 42, 43]. Основні шлунково-кишкові та поліорганні клінічні прояви целіакії представлено в таблиці.
Для целіакії можуть бути характерні специфічні зміни в гематологічних і біохімічних аналізах крові [46]. Низький рівень альбуміну, гемоглобіну та мікроелементів, як-от калій, кальцій, вітамін D
і магній, асоціюється з класичною целіакією. Також серед пацієнтів із целіакією є поширеними низькі показники феритину та мікроцитарна анемія [47]. Навіть за відсутності інших відповідних симптомів криптогенне підвищення трансаміназ може сигналізувати про дебют целіакії; рівні печінкових ферментів повертаються до нормального діапазону протягом 6-12 місяців після впровадження БГД [49].
Визначення характерних морфологічних змін слизової оболонки кишківника та серологічні дослідження (встановлення рівнів автоантитіл до тканинної трансглютамінази 2 типу [TG2], антиендомізіальних антитіл [EmA] й антитіл до дезамінованих пептидів гліадину [DGP]) є основними інструментами для діагностики целіакії [1]. Ендоскопія виконується після серологічних тестів, які включають визначення антитіл до EmA та TG2 [2]. Серологічні тести є дуже точними та чутливими: їхня чутливість досягає 90-100%, а специфічність – 100%, але серодіагностика має свої обмеження [35]. ЕmА-тестування довгий час вважалося золотим стандартом для виявлення автоантитіл у разі целіакії, проте його результат може бути хибнонегативним за дефіциту IgA [2]. Низький рівень антитіл до TG2 може бути пов’язаний з інфекційними й автоімунними захворюваннями, наприклад із цукровим діабетом 1 типу [36]. Тест на антитіла до DGP використовується для серодіагностики целіакії у випадках, які не виявляються за допомогою тестів EmA та TG2 [54]. Приблизно 10% пацієнтів із целіакією є серонегативними, тобто не виявляються жодним із наявних серологічних методів; у таких пацієнтів установлення діагнозу залежить виключно від результатів гістологічного дослідження біоптату дванадцятипалої кишки [37]. Проведення генетичного тестування на наявність HLA-DQ2/HLA-DQ8 може бути важливим, оскільки негативний результат остаточно виключає целіакію та змушує шукати інші причини атрофії війок [1].
Біопсія дванадцятипалої кишки залишається основним методом морфологічної оцінки при підтвердженні целіакії, а гістологія – золотим стандартом діагностики цього захворювання [52]. Рекомендується проводити забір 4 біоптатів із низхідної частини дванадцятипалої кишки та 2 біоптатів цибулини дванадцятипалої кишки [57]. Згідно з класифікацією Marsh (модифікованою Oberhüber) різні типи ураження слизової оболонки кишківника поділяються на 5 стадій [58]. Перша стадія ураження характеризується високим умістом інтестинальних інтраепітеліальних лімфоцитів – ІЕЛ (для целіакії характерним числом ІЕЛ вважається ≥25 лімфоцитів на 100 епітеліальних клітин) без гіперплазії крипт і змін війок; за другої стадії спостерігається підвищення вмісту ІЕЛ із гіперплазією крипт і без змін війок. Для потенційної целіакії характерні позитивні анти-TG2 й анти-EmA при мінімальному ураженні кишківника. Крім того, мінімальне ураження кишківника може спостерігатися при харчовій алергії (наприклад, на білок коров’ячого молока), хворобі Крона, лімфоцитарному коліті. Типове для целіакії ураження кишківника (стадія 3 за Marsh) демонструє атрофію війок зі зміною співвідношення війок до крипт і збільшенням ІЕЛ. Ураження третього типу поділяються на підтипи залежно від тяжкості атрофії війок: 3a – легка атрофія, 3b – атрофія середнього ступеня, 3c – субтотальна атрофія [58].
Дуоденальна біопсія є вирішальним чинником для встановлення правильного діагнозу, оскільки визначення сироваткових антитіл не може забезпечити стовідсоткову чутливість і специфічність [1]. Згідно з нещодавніми рекомендаціями Європейського товариства дитячої гастроентерології, гепатології та нутриціології (ESPGHAN) у педіатричній практиці допускається встановлення діагнозу целіакії без проведення дуоденальної біопсії, за наявності клінічних проявів целіакії, високих рівнів антитіл до тиреоглобуліну, позитивних результатів дослідження ЕmА, наявності HLA-DQ2/HLA-DQ8 [1, 40]. Незважаючи на це, біопсія дванадцятипалої кишки залишається важливою частиною діагностики дорослих пацієнтів із підозрою на целіакію.
Сучасний золотий стандарт медичної допомоги при целіакії стверджує, що 4 з 5 наступних умов є достатніми для діагностики цього захворювання [1, 45]: наявність типових ознак і симптомів, які включають діарею та мальабсорбцію; позитивні тести на антитіла (TG2, EmA, DGP); позитивний HLA-DQ2 та/або HLA-DQ8, атрофія війок і пошкодження кишківника при дуоденальній біопсії, а також клінічне поліпшення внаслідок дотримання БГД. Відсутність ураження кишківника вказує на потенційну целіакію, відсутність позитивних антитіл – на серонегативну целіакію, відсутність типових ознак і симптомів – на некласичну целіакію, тоді як відсутність відповіді на БГД вказує на резистентну целіакію [1].
Потенційна целіакія характеризується позитивними антитілами (IgA EmA й анти-ТТГ), наявністю HLA-DQ2/HLA-DQ8, нормальною слизовою оболонкою кишківника та незначними ознаками запалення [28]. Слизова оболонка кишківника за потенційної целіакії є незміненою або незначно запаленою через збільшення числа ІЕЛ [29]. Пацієнти з потенційною целіакією можуть бути безсимптомними або мати позакишкові симптоми [29]. Більшість дітей (80%), які страждають на потенційну целіакію, є безсимптомними, а інші 20% мають кишкові симптоми та позакишкові ознаки, як-от відставання в антропометричних показниках [30, 31]. У дорослих пацієнтів із потенційною целіакією симптоматика трапляється частіше, ніж у дітей, і переважно це позакишкові прояви [30-32]. Сучасні дослідження припускають, що лише симптоматичні пацієнти з потенційною целіакією мають дотримуватися БГД [30-32]. Однак лише невеликий відсоток пацієнтів із потенційною целіакією дотримується БГД, і в них розвивається атрофія війок [29, 30, 32].
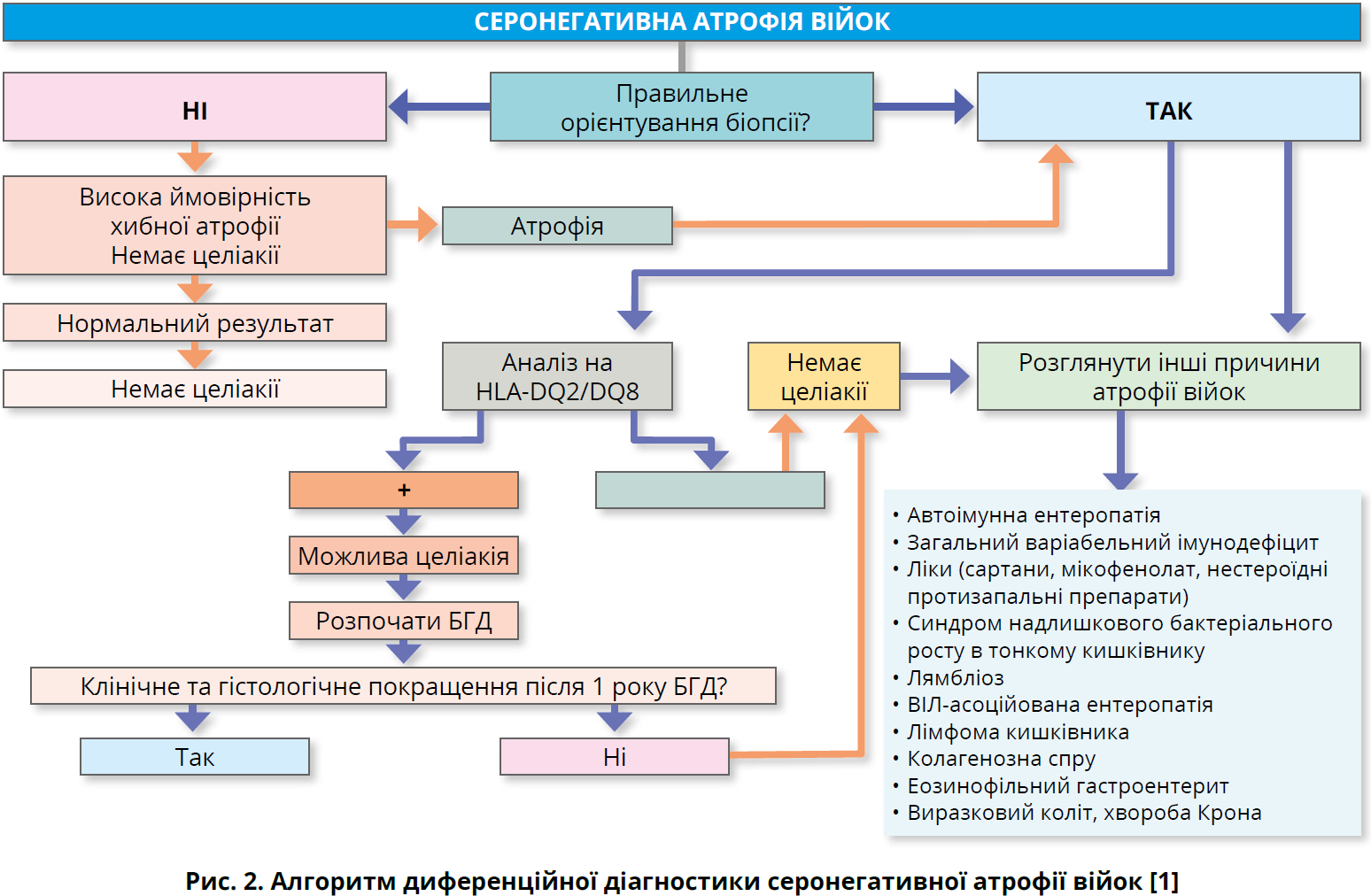
Алгоритм діагностики целіакії представлено на рисунку 1. Алгоритм диференційної діагностики серонегативної атрофії війок наведено на рисунку 2.
Ускладнення та наслідки целіакії
Більшість доказів свідчить про те, що пізня діагностика целіакії та/або недотримання суворої БГД підвищують рівень смертності порівняно із загальною популяцією [60]. Найпоширенішими ускладненнями целіакії серед пацієнтів похилого віку є гіпоспленізм, рефрактерна целіакія та виразковий ілеїт [1]. Близько 30% дорослих хворих на целіакію мають гіпоспленізм, який асоціюється з іншими автоімунними захворюваннями, як-от виразковий ілеїт і лімфома, а також бактеріальними інфекціями, особливо спричиненими інкапсульованими бактеріями, як-от менінгокок і пневмокок [51, 61]. Рефрактерна целіакія асоціюється з мальабсорбцією, зниженням індексу маси тіла та діареєю, але вона становить лише близько 1-1,5% від усіх випадків целіакії. Зазвичай діагноз рефрактерної целіакії встановлюється після 1 року БГД на підставі відсутності покращення серологічних показників [62].
Найпоширенішими аліментарними наслідками целіакії є дефіцит заліза, вітаміну В12, вітаміну D та кальцію, фолієвої кислоти, мікроелементів і мінералів [63, 64]. Усі ці дефіцити поживних речовин пов’язані з такими традиційними симптомами, як діарея та коливання індексу маси тіла [2]. Більшість досліджень дійшли висновку, що БГД спричиняє дисбаланс поживних речовин і може бути пов’язана з дефіцитом вітамінів і мінералів, а також некрохмалистих полісахаридів [2, 63, 64]. Тому ідеальне лікування включає в себе збалансований раціон, а дефіцит поживних речовин потрібно діагностувати та лікувати за допомогою дієтичних добавок [63, 64].
Лікування целіакії
На сьогодні єдиним ефективним методом лікування целіакії є дотримання БГД, заснованої на вживанні безглютенової їжі, як-от фрукти, овочі, бобові та безглютенові крупи. Рекомендована кількість глютену для пацієнтів із целіакією не перевищує 10 мг глютену на добу, проте рівень толерантності до глютену серед пацієнтів із целіакією може бути варіабельним. Згідно зі стандартами Аліментарного кодексу Всесвітньої організації охорони здоров’я [92] та нормами Управління з контролю продуктів харчування й лікарських засобів США (FDA) безглютенові продукти мають містити <20 часточок на мільйон (ppm) глютену, що еквівалентно 20 мг глютену на кілограм продукту [12].
Постійне суворе дотримання БГД є єдиним рекомендованим лікуванням для пацієнтів із целіакією [3, 8, 9, 44, 81-83]. За даними Catassi та співавт., у пацієнтів із целіакією споживання 50 мг глютену на добу протягом 3 місяців може призвести до руйнування війок тонкої кишки [84]. Дотримання БГД сприяє загоєнню епітелію тонкого кишківника та покращенню клінічної симптоматики (найперше шлунково-кишкових симптомів) [12]. Окрім того, гістологічне дослідження тонкого кишківника, серологічні тести, загальноклінічні аналізи й оцінка харчового анамнезу є клінічними контрольними точками, які використовуються для підтвердження прихильності до БГД [87]. Найточнішим методом перевірки прихильності пацієнтів до БГД є проведення біопсії дванадцятипалої кишки та подальше гістологічне дослідження.
Рекомендації
- Дуоденальна біопсія залишається основним і найважливішим інструментом діагностики целіакії; серологічне дослідження не може замінити біопсію в діагностиці целіакії в дорослих.
- Пацієнти мають дотримуватися БГД і споживати менш як 10 мг глютену на добу, а метою подальшого спостереження є забезпечення суворого дотримання БГД.
- Вагітним пацієнткам із целіакією рекомендовано дотримання БГД для зниження ризику несприятливих наслідків для плода.
- Якщо дотримання БГД є проблематичним, пацієнти з целіакією мають спостерігатися дієтологом та/або лікарем, який має відповідний досвід.
- Симптоматичні пацієнти із целіакією мають отримувати ретельніше обстеження, ніж асимптоматичні.
- Пацієнтів слід заохочувати приєднатися до місцевої групи підтримки хворих на целіакію відразу після встановлення діагнозу.
- Пацієнтам, які за результатами фіброезогастродуоденоскопії (ФЕГДС) мають ендоскопічні ознаки, що вказують на целіакію, а також демонструють клінічні та лабораторні знахідки, характерні для целіакії, варто призначити біопсію дванадцятипалої кишки.
- HLA-типування проводиться для виключення діагнозу целіакії. Виявлення гаплотипів HLA DQ2.5 або DQ8 саме по собі не є достатнім для підтвердження діагнозу целіакії.
- Для осіб, які самостійно та без адекватної діагностики целіакії перейшли на БГД, може проводитися HLA-типування.
- В осіб із високим ризиком целіакії (наприклад, у родичів першого ступеня спорідненості) для виключення діагнозу целіакії та зменшення кількості обстежень може бути використане HLA-
типування. - У близьких родичів пацієнтів із целіакією, що демонструють клінічні симптоми цього захворювання, потрібно проводити лабораторні та гістологічні дослідження.
- Для встановлення діагнозу целіакії потрібне проведення біопсії дванадцятипалої кишки (якщо пацієнт дотримується глютеновмісної дієти). Для переважної більшості дорослих пацієнтів установлення діагнозу целіакії потребує позитивних результатів серологічного дослідження.
- Якщо під час проведення ФЕГДС виявляються ознаки целіакії, потрібно виконати забір 4 біоптатів із низхідної частини дванадцятипалої кишки та 2 біоптатів цибулини дванадцятипалої кишки.
- Слід розглянути можливість призначення біопсії дванадцятипалої кишки в серологічно негативних пацієнтів, які мають симптоми мальабсорбції (наприклад, анемію чи діарею) або обтяжений сімейний анамнез щодо целіакії.
- Повторні біопсії можуть бути потенційно корисними для виявлення пацієнтів із целіакією, які мають підвищений ризик розвитку лімфоми.
- Повторні біопсії не є обов’язковими, якщо пацієнт із целіакією при дотриманні БГД не має симптомів захворювання й інших ознак, які вказували би на підвищений ризик ускладнень.
- Контрольні біопсії варто проводити пацієнтам із целіакією, які не демонструють покращення стану при дотриманні БГД.
- Пацієнтам із целіакією, які мають додаткові чинники ризику остеопорозу або є старшими за 55 років, слід отримати щеплення пневмококовою вакциною.
- Хворим, які мають додаткові чинники ризику остеопорозу або є старшими за 55 років, потрібно проводити денситометрію після 1 року дотримання БГД.
- Дорослі пацієнти із целіакією мають отримувати не менш ніж 1000 мг кальцію на добу.
- Пацієнти із целіакією мають проходити щорічне гематологічне та біохімічне обстеження.
- Дотримання БГД є основним заходом профілактики остеопорозу в пацієнтів із целіакією.
Література
Nour Amin Elsahoryi. Celiac Disease. Published: 14 July 2021. Available at: https://www.intechopen.com/chapters/76955. DOI: 10.5772/intechopen.97834.
Освітньо-практичний журнал Gastro Practice №1 2023р.