Case challenge «Лікування пацієнта з метаболічно-асоційованим стеатогепатитом»: погляди гастроентеролога, ендокринолога та кардіолога
Підготувала канд. мед. наук Тетяна Можина
Ведення пацієнтів зі стеатотичною хворобою печінки (СХП) потребує мультидисциплінарного підходу. 30 травня на навчальній платформі «Школа інноваційної медицини» в рамках Case challenge відбувся черговий семінар, на якому зустрілися три експертки: гастроентеролог Олена Бака, завідувачка гастроентерологічного відділення ДНУ «Центр інноваційних медичних технологій» НАН України; ендокринолог Любов Соколова, завідувачка відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України»; та кардіолог Лариса Міщенко, завідувачка відділу артеріальної гіпертензії та коморбідної патології ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. М.Д. Стражеска» НАМН України». На цей раз провідні вітчизняні експертки обговорювали особливості лікування хворого з метаболічно-асоційованим стеатогепатитом (МАСГ).
 Розпочала семінар гастроентеролог Олена Бака з короткого історичного огляду трансформації термінів «неалкогольна жирова хвороба печінки» (НАЖХП) та «неалкогольний стеатогепатит» (НАСГ). Зміна ставлення до виникнення й особливостей прогресування захворювання зумовила появу поняття «метаболічно-асоційована жирова хвороба печінки» (МАЖХП), яке згодом трансформувалося в СХП. Саме остання дефініція та відповідні зміни класифікації були підтримані одразу трьома провідними світовими гепатологічними організаціями: Європейською асоціацією з вивчення печінки (EASL), Американською асоціацією з вивчення захворювань печінки (AASLD), Латиноамериканською асоціацією з вивчення печінки (ALEH). Згідно із сучасною класифікацією виділяють СХП, пов’язану з метаболічною дисфункцією (СХПМД); алкоголь-асоційовану хворобу печінки, пов’язану з метаболічною дисфункцією (МетАХП), алкоголь-асоційовану хворобу печінки (АХП), СХП зі специфічною етіологією та криптогенну СХП.
Розпочала семінар гастроентеролог Олена Бака з короткого історичного огляду трансформації термінів «неалкогольна жирова хвороба печінки» (НАЖХП) та «неалкогольний стеатогепатит» (НАСГ). Зміна ставлення до виникнення й особливостей прогресування захворювання зумовила появу поняття «метаболічно-асоційована жирова хвороба печінки» (МАЖХП), яке згодом трансформувалося в СХП. Саме остання дефініція та відповідні зміни класифікації були підтримані одразу трьома провідними світовими гепатологічними організаціями: Європейською асоціацією з вивчення печінки (EASL), Американською асоціацією з вивчення захворювань печінки (AASLD), Латиноамериканською асоціацією з вивчення печінки (ALEH). Згідно із сучасною класифікацією виділяють СХП, пов’язану з метаболічною дисфункцією (СХПМД); алкоголь-асоційовану хворобу печінки, пов’язану з метаболічною дисфункцією (МетАХП), алкоголь-асоційовану хворобу печінки (АХП), СХП зі специфічною етіологією та криптогенну СХП.
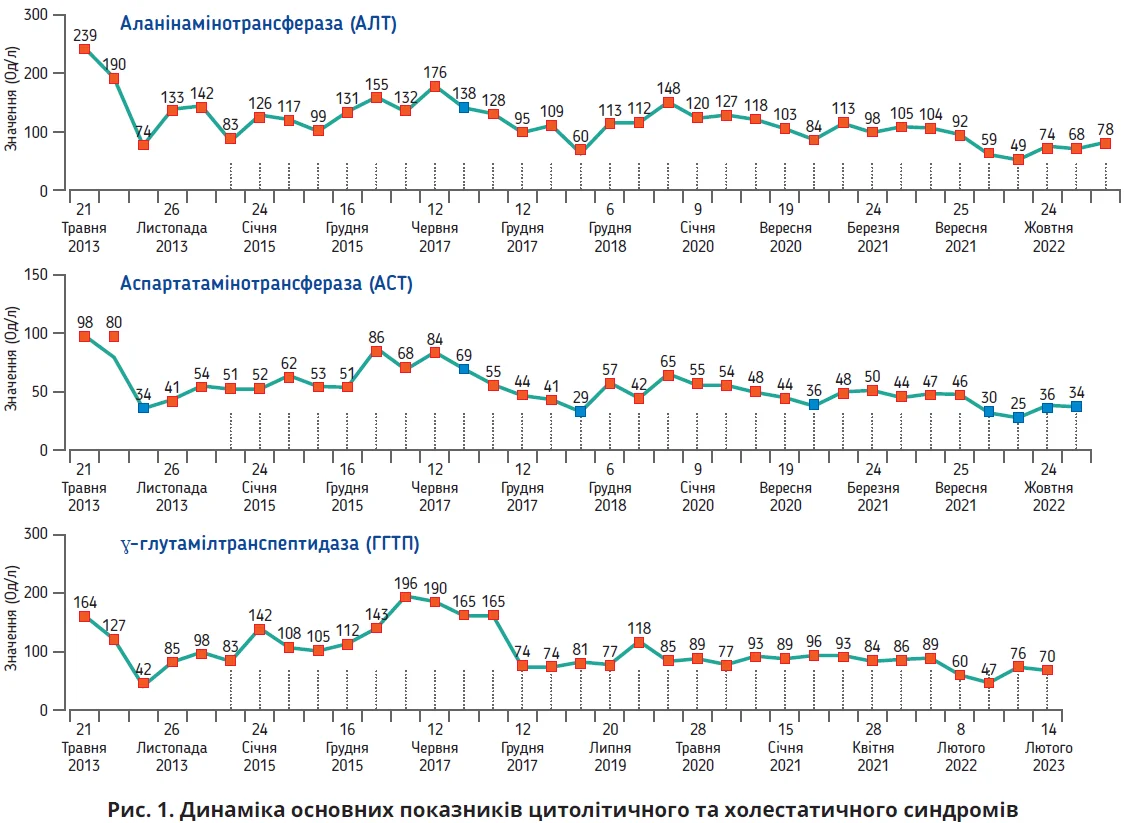
Доповідачка представила головного героя Case challenge: пацієнта Р., 1957 р. н., у якого у 2013 р. виявили високу активність цитолітичного синдрому (АЛТ – 239 Од/л, АСТ – 98 Од/л) на тлі відсутності інфікування вірусними гепатитами В та С, негативних маркерів автоімунної патології печінки.
Проведене ретельне обстеження дало змогу встановити діагноз НАСГ із вираженою активністю, ожиріння 2-го ступеня (індекс маси тіла [ІМТ] – 37,9 кг/м²), цукровий діабет (ЦД) 2-го типу, середнього ступеня тяжкості, стадія субкомпенсації, гіпертонічна хвороба ІІ ст.
Відповідно до рекомендацій, які діяли на той час, пацієнту призначили нефармакологічну та фармакологічну терапію. Корекція дієти, збільшення фізичної активності сприяли позитивним змінам ІМТ: протягом 2013-2018 рр. показник знизився з 37,9 до 32,4 кг/м², але після оголошення пандемії COVID-19 і запровадження карантинних обмежень, які призвели до значного скорочення рухового режиму, спостерігали поступове зростання ІМТ, який у 2023 р. досяг вихідних значень – 37,9 кг/м².
Призначена фармакотерапія сприяла значному зниженню активності цитолітичного та холестатичного синдромів (рис. 1), але на тлі порушення дієти, періодичного вживання невеликих/середніх доз алкоголю відзначали неодноразові прояви активності захворювання протягом багаторічного періоду спостереження.
Останнє ультразвукове дослідження, виконане у 2023 р., виявило дифузні зміни печінки за типом жирового гепатозу, ознаки хронічного безкам’яного холециститу, хронічного панкреатиту.
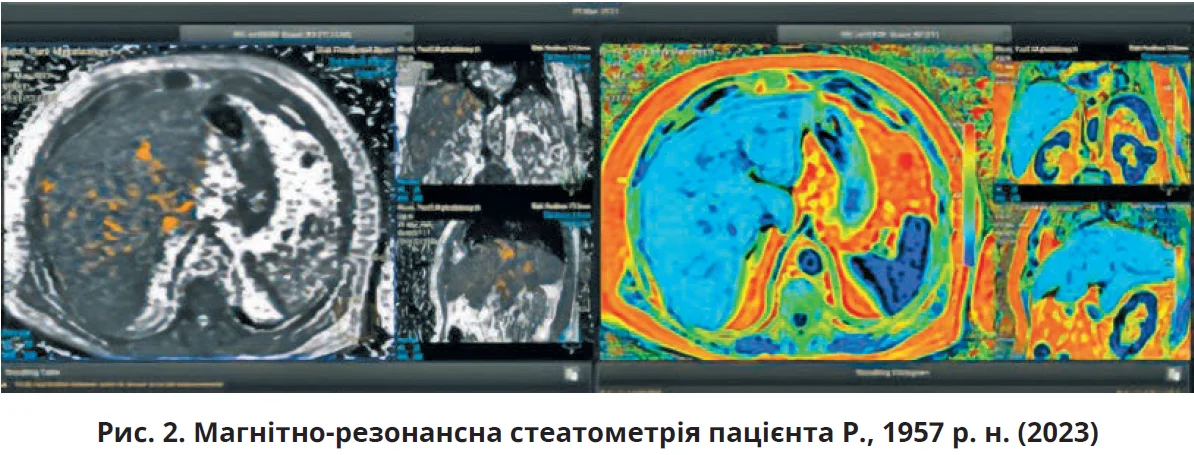
Під час проведення стеатоеластометрії діагностували фіброз печінки F3 за шкалою METAVIR, ці дані підтверджено шляхом магнітно-резонансної стеатометрії: при загальному об’ємі печінки 2747 см3 насичення жиром становило 20,1-24,9% (дані змінювалися залежно від використаної розрахункової формули), що значно перевищувало нормативні показники (рис. 2).
Аналізуючи вищенаведені дані, спікерка підкреслила, що пацієнт має всі фактори ризику прогресування захворювання: високий ІМТ, похилий вік, високий індекс АСТ/АЛТ, підвищений рівень АЛТ, глікемії натще, глікозильованого гемоглобіну (HbA1c), тригліцеридів (ТГ), а також супутні ЦД, артеріальну гіпертензію. Згідно із сучасними доказовими даними фіброз печінки визнано вірогідним фактором ризику смертності при НАЖХП, причиною якої може бути як захворювання печінки, так і різноманітні серцево-судинні захворювання (ССЗ). Ризик смерті прогресивно збільшується зі зростанням стадії фіброзу печінки від F0 до F4. Отже, пацієнт Р. має підвищений ризик смерті, мінімізування котрого можна досягти за умови гальмування прогресування фіброзу печінки.
Дані доказової медицини свідчать, що СХПМД передує та призводить до розвитку ЦД 2-го типу, який, своєю чергою, створює умови для виникнення НАСГ і збільшує ризик розвитку цирозу печінки, гепатоцелюлярної карциноми. Доведено, що на тлі ЦД ризик розвитку СХПМД зростає у 2,2 раза; з іншого боку, СХПМД зумовлює зростання інсулінорезистентності, ускладнює перебіг ЦД й утруднює досягнення його компенсації, збільшує ризик атерогенної дисліпідемії та виникнення ССЗ. Окрім системного впливу, СХПМД погіршує прогноз саме для печінки, спричиняючи зростання ризику фіброзу печінки у 2-6 разів.
 Ендокринолог Любов Соколова зауважила, що згідно з оновленою номенклатурою діагностування СХП можливе за наявності щонайменше одного з таких п’яти кардіометаболічних критеріїв:
Ендокринолог Любов Соколова зауважила, що згідно з оновленою номенклатурою діагностування СХП можливе за наявності щонайменше одного з таких п’яти кардіометаболічних критеріїв:
- ІМТ ≥25 кг/м2 (для осіб азійського походження – ≥23 кг/м2), або окружність талії ≥94 см у чоловіків і ≥80 см у жінок, або етнічна приналежність;
- рівень глюкози натще ≥5,6 ммоль/л (≥100 мг/дл) або через 2 години після навантаження глюкозою ≥7,8 ммоль/л (≥140 мг/дл), або рівень HbA1c ≥5,7% (≥39 ммоль/л), або наявність ЦД 2-го типу в анамнезі, або лікування ЦД 2-го типу;
- артеріальний тиск (АТ) ≥130/85 мм рт. ст. або специфічне лікування артеріальної гіпертензії;
- вміст ТГ крові ≥1,70 ммоль/л (≥150 мг/дл) або специфічне лікування, спрямоване на зниження вмісту ліпідів;
- рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) ≤1,0 ммоль/л (≤40 мг/дл) у чоловіків і ≤1,3 ммоль/л (≤50 мг/дл) у жінок або специфічне лікування, спрямоване на зниження концентрації ліпідів.
На думку доповідачки, високі рівні HbA1c у пацієнта Р. у 2017 та 2024 рр. (9,07 та 9,15 ммоль/л відповідно) віддзеркалюють періоди зростання активності хронічного запального процесу на тлі ожиріння. Нормативні значення С-пептиду (3,07 нг/мл за норми 0,9-7,1 нг/мл) свідчать про збережену функціональну здатність ендокринної частини підшлункової залози, але гіперінсулінемія, котра виникла на тлі метаболічного синдрому, одночасно з високим рівнем глікемії натще зумовила зростання вмісту HbA1c. Наведене клінічне спостереження повністю відповідає світовим даним, які свідчать, що 91% і 37% хворих на ожиріння одночасно страждають на НАЖХП та НАСГ відповідно. Водночас НАСГ діагностують у 82% хворих на ожиріння, 44% пацієнтів із ЦД 2-го типу, 72% осіб із дисліпідемією, 68% хворих на артеріальну гіпертензію та 71% пацієнтів із метаболічним синдромом. Саме тому сучасний підхід до лікування СХПМД передбачає одночасну корекцію декількох патологічних процесів: метаболічного стресу, інсулінорезистентності, системного запалення, що дає змогу захистити органи-мішені (артерії, серце, печінку, підшлункову залозу, нирки).
Коротко розглянувши основні патогенетичні шляхи поліпшення стану хворих на СХП, провідний ендокринолог підкреслила необхідність нормалізування маси тіла, зменшення кількості вісцеральної жирової тканини як засобу покращення гістологічного стану печінки у хворих на МАСГ. Із цією метою сучасні міжнародні настанови рекомендують збільшувати рухову активність і фізичні навантаження, раціоналізувати харчовий раціон, мінімізувати або повністю відмовитися від споживання алкогольних напоїв (особливо при прогресивному цирозі печінки F3-F4). За недостатньої ефективності зазначених заходів передбачено призначення спеціалізованої фармакотерапії (фентермін, фентермін/топірамат ER, налтрексон/бупропіон, орлістат, ліраглутид, семаглутид) і баріатричної хірургії. Згідно з рекомендаціями AASLD й Американської діабетологічної асоціації (ADA) слід намагатися знизити масу тіла на >10% від вихідного рівня за рахунок фізичних вправ, призначення агоністів рецепторів глюкагоноподібного пептиду-1 (ГПП-1), проведення баріатричних втручань, тоді як експерти EASL й Американської гастроентерологічної асоціації (AGA) рекомендують знижувати масу тіла в межах 7-10% завдяки переважно фізичним вправам.
Спікерка розглянула основні положення лікування ЦД при СХПМД. Мета фармакотерапії ЦД полягає в оптимізації контролю глюкози за допомогою засобів, здатних забезпечити регрес стеатогепатиту. Із цією метою призначають агоністи ГПП-1 та інгібітори натрієзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2) за наявності супутніх ССЗ; за умов ураження нирок і наявності хронічного захворювання нирок – іНЗКТГ-2. Хворим на НАЖХП з низьким і середнім ризиком виникнення фіброзу можна рекомендувати метформін, інгібітори дипептидилпептидази-4, акарбозу й інсулін, але їхня користь вважається обмеженою через мінімальну здатність впливати на гістологічний стан печінки.
 Особливості ведення хворих на МАСГ із погляду кардіолога розкрила Лариса Міщенко, яка наголосила, що СХПМД має велику кількість кардіальних ускладнень: за даними сучасних метааналізів, вищі ступені СХПМД асоційовані з високим серцево-судинним (СС) ризиком, високою ймовірністю виникнення атеросклеротичних ССЗ, атеросклерозу коронарних судин і високим ризиком СС-подій, у тому числі інфаркту міокарда. Доведено, що перебіг СХПМД супроводжується високою ймовірністю розвитку діастолічної дисфункції лівого шлуночка та формування серцевої недостатності, появою різноманітних аритмій, у тому числі фібриляції передсердь. Установленим фактом є зростання ризику атеросклеротичних ССЗ одночасно зі збільшенням тяжкості СХПМД. Такий феномен взаємного обтяження пояснюють поєднанням провідних патогенетичних механізмів, які відбуваються на тлі як СХПМД, так і ССЗ: системне й судинне запалення, ендотеліальна дисфункція, атерогенна дисліпідемія, порушення вуглеводного метаболізму та кишкового мікробіому.
Особливості ведення хворих на МАСГ із погляду кардіолога розкрила Лариса Міщенко, яка наголосила, що СХПМД має велику кількість кардіальних ускладнень: за даними сучасних метааналізів, вищі ступені СХПМД асоційовані з високим серцево-судинним (СС) ризиком, високою ймовірністю виникнення атеросклеротичних ССЗ, атеросклерозу коронарних судин і високим ризиком СС-подій, у тому числі інфаркту міокарда. Доведено, що перебіг СХПМД супроводжується високою ймовірністю розвитку діастолічної дисфункції лівого шлуночка та формування серцевої недостатності, появою різноманітних аритмій, у тому числі фібриляції передсердь. Установленим фактом є зростання ризику атеросклеротичних ССЗ одночасно зі збільшенням тяжкості СХПМД. Такий феномен взаємного обтяження пояснюють поєднанням провідних патогенетичних механізмів, які відбуваються на тлі як СХПМД, так і ССЗ: системне й судинне запалення, ендотеліальна дисфункція, атерогенна дисліпідемія, порушення вуглеводного метаболізму та кишкового мікробіому.
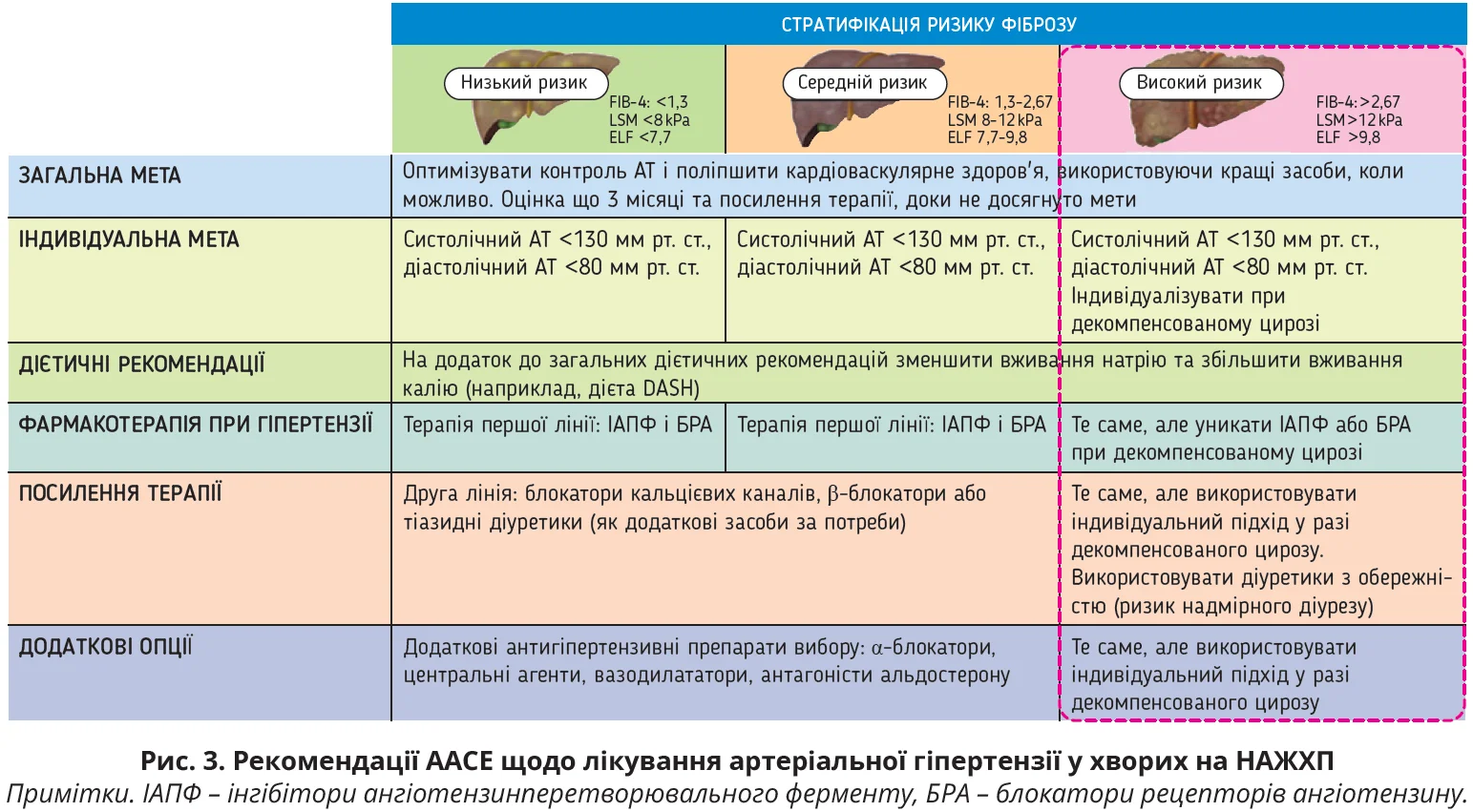
Обов’язковою умовою ведення таких хворих є корекція АТ і ліпідного обміну. Способи ефективного контролю факторів СС-ризику у хворих на СХПМД спікерка пояснила, представивши аналіз рекомендацій Американської асоціації клінічної ендокринології (ААСЕ), в яких передбачено покроковий підхід до корекції артеріальної гіпертензії залежно від стадії фіброзу печінки (рис. 3).
Іншим дуже важливим компонентом ведення хворих на СХПМД є корекція ліпідного обміну з досягненням цільових рівнів холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) залежно від категорії ризику ССЗ за допомогою статинотерапії. При цьому згідно з рекомендаціями Європейського товариства кардіологів (ESC, 2019) слід орієнтуватися на такі цільові значення ХС ЛПНЩ: в осіб із помірним СС-ризиком треба намагатися досягти рівня цього показника 2,6 ммоль/л, у хворих із високим або дуже високим СС-ризиком – 1,8 та 1,4 ммоль/л відповідно або зменшити вміст ХС ЛПНЩ на 50% від вихідного рівня.
Доповідачка підкреслила, що більшість лікарів-практиків вагається та сумнівається в доцільності призначення статинів хворим із супутніми хронічними захворюваннями печінки. Ці побоювання нівелюють дані доказової медицини: результати масштабного популяційного дослідження свідчать, що високодозова статинотерапія (20-40 мг розувастатину, 40-80 мг аторвастатину) знижує ризик смерті від усіх причин в осіб із хронічною патологією печінки та ССЗ порівняно з помірними/низькими дозами статинів. Потенційні позитивні ефекти статинів у разі СХП досить багатогранні: вони дають змогу знизити ступінь стеатозу печінки, зменшити активність запального процесу та загальмувати фіброзоутворення, тобто статини сприяють розрішенню НАСГ і регресії фіброзу печінки. Крім цього, статини зменшують тиск у портальній системі, знижують явища портальної гіпертензії та покращують гемодинаміку, а також демонструють здатність протидіяти гепатокарциногенезу, запобігаючи розвитку гепатоцелюлярної карциноми.
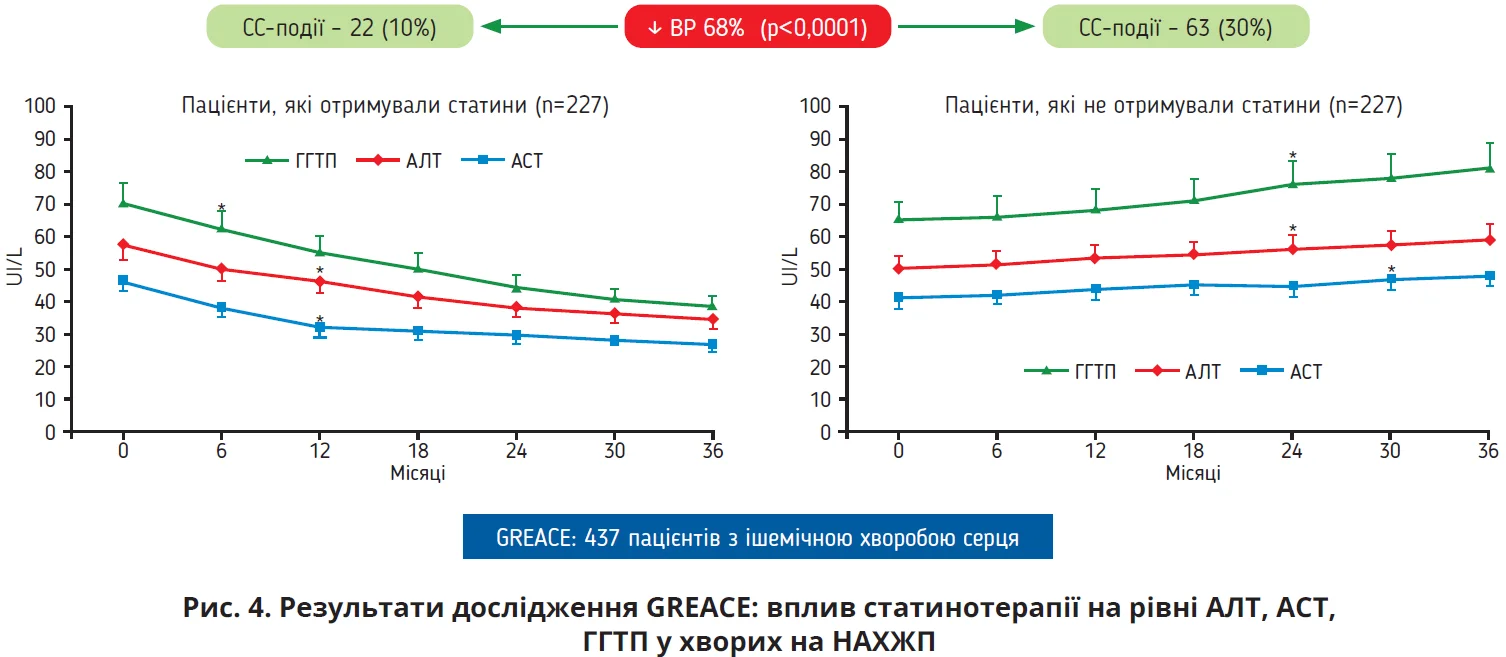
Основним побоюванням клініцистів у разі призначення статинів хворим на СХПМД є можливе підвищення активності цитолітичного синдрому. Результати дослідження GREACE, в якому взяли участь 437 пацієнтів з ішемічною хворобою серця, свідчать про протилежний ефект статинів (рис. 4). На початку дослідження GREACE всі хворі мали помірно підвищений рівень АЛТ й АСТ, але, незважаючи на це, їх розподілили для прийому статинів (n=227; переважно застосовували аторвастатин у середній дозі 24 мг/добу) або відсутності супутньої статинотерапії (n=210). У групі хворих, які отримували статини, зафіксували всього 22 СС-випадки (10%), тоді як у групі «без статинів» – 63 випадки (30%). Причому в групі статинотерапії протягом усього періоду спостереження констатували вірогідне зниження рівнів АЛТ, АСТ, ГГТП; вміст зазначених показників у хворих, які не приймали статини, навпаки, не тільки не залишався на вихідному рівні, але й продовжував зростати (рис. 4).
Отже, призначення статинів хворим на СХПМД асоційовано з вірогідним зменшенням СС-ризику (відносний ризик [ВР] 68%; р<0,0001) та сприяє нормалізації рівнів АЛТ, АСТ, ГГТП.
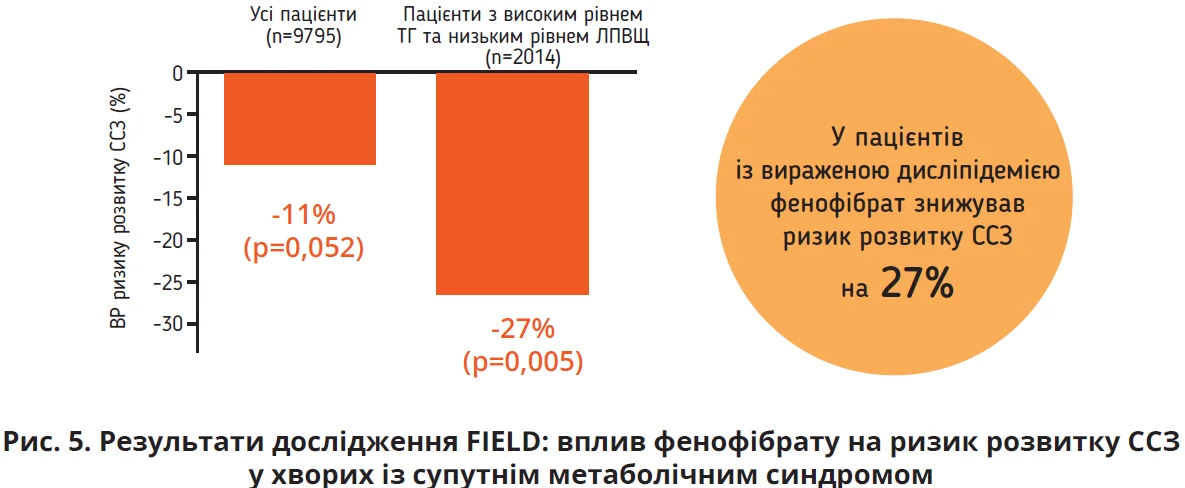
Із метою нормалізації вмісту холестерину у хворих на СХПМД міжнародні настанови рекомендують застосовувати статини (вони визнані засобами першої лінії ліпідознижувальної терапії). Якщо на тлі статинотерапії зберігається високий рівень ТГ (>2,7 ммоль/л), потрібно додати препарат із групи фібратів, а саме фенофібрат. Фенофібрат має доказову базу щодо здатності знижувати рівень ТГ, збільшувати концентрацію ХС ЛПВЩ, покращувати прогноз щодо ССЗ, особливо у хворих із супутніми ЦД та метаболічним синдромом (рис. 5), а також зменшувати активність НАЖХП. Тому нашому пацієнту треба спочатку призначити статин, а за умови збереження високого рівня ТГ додати єдиний зареєстрований в Україні препарат із групи фібратів – фенофібрат (Трайкор®). Доповідачка зауважила, що пацієнтам із супутнім ЦД краще віддавати перевагу призначенню не омега-3-жирних кислот, а саме фенофібрату. Цю рекомендацію вона пояснила здатністю фенофібрату зменшувати явища діабетичної проліферативної ретинопатії, особливо на стадії препроліферації (рис. 5). Саме завдяки фенофібрату можна зменшити мікроциркуляторні зміни, які відбуваються на тлі ЦД в усіх органах-
мішенях: сітківці, коронарних судинах, печінці та підшлунковій залозі, нирках.
Продовжуючи дискусію щодо лікування пацієнта, гастроентеролог Олена Бака, ендокринолог Любов Соколова та кардіолог Лариса Міщенко дійшли одностайного висновку, що поліпшення функціональної активності печінки та нормалізування значень АЛТ, АСТ, ГГТП надасть змогу лікарям спокійніше призначати гіполіпідемічну терапію
й підібрати необхідні гіпоглікемічні засоби. Тому хворі на СХПМД потребують безпечного та за можливості швидкого покращення функціональної здатності гепатоцитів. Із цією метою застосовують S-аденозил-L-метіонін (SAMe), відомий під торговою назвою Гептрал® (Abbott, США). Провідні фахівці світу наголошують на необхідності визначення ризику розвитку фіброзу печінки на підставі розрахунку індексу F4 / проведення еластометрії. Одним із засобів, який потенційно може впливати на перебіг СХПМД, є SAMe через здатність покращувати гістологічну структуру печінки, зменшуючи ступінь її стеатозу за даними ультразвукового дослідження.
Результати численних експериментальних і клінічних досліджень свідчать, що SAMe активує синтез ендогенного антиоксиданту глутатіону, забезпечуючи захист від вільних радикалів і сприяючи розвитку антиоксидантного ефекту. Посилення синтезу фосфатидилхоліну на тлі застосування SAMe забезпечує відновлення структури та функцій гепатоцитів,
а також супроводжується поліпшенням показників вуглеводного й ліпідного обмінів, посиленням елімінації ТГ і ХС ЛПНЩ з печінки, покращенням регуляції глюконеогенезу в печінці. Терапія SAMe асоційована зі зменшенням активності запалення, рівня прозапальних цитокінів, гальмуванням синтезу колагену та швидкості фіброзування.
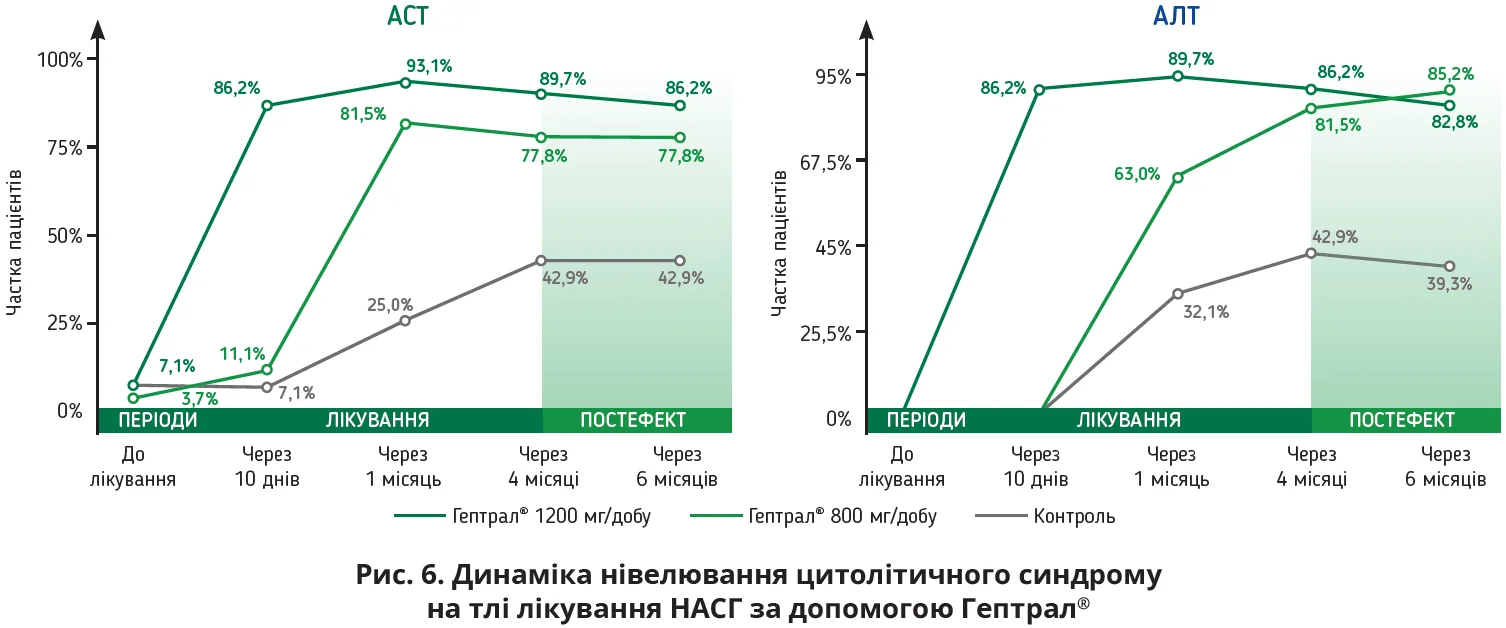
Декілька клінічних досліджень довели, що прийом препарату Гептрал® хворими на НАСГ асоціюється з покращенням функціональної активності гепатоцитів і зменшенням гепатогенної втоми як одного із симптомів внутрішньо печінкового холестазу; зазвичай вірогідну нормалізацію рівнів АЛТ, АСТ спостерігають уже на 7-10-ту добу терапії (рис. 6). SAMe притаманний дозозалежний ефект: швидша нормалізація показників АЛТ, АСТ відбувалася на тлі прийому 1200 мг порівняно з 800 мг SAMe, плацебо. Тривала терапія SAMe супроводжується додатковими перевагами: його застосування протягом 1 місяця асоціюється з покращенням показників ліпідограми, прийом препарату протягом 2 місяців дає змогу покращити ультразвукову картину печінки, 3-місячне лікування – зберегти досягнуті результати до 2-3 місяців (постефект). Здатність препарату Гептрал® одночасно нормалізувати рівень цитолітичних ферментів і показники ліпідограми дуже важлива для хворих на СХП, адже, з одного боку, SAMe підсилюватиме гіполіпідемічну дію статинів, з іншого – підтримуватиме функціональну активність гепатоцитів.
Ведення та лікування хворих на СХП/МАСГ є непростим завданням, яке до снаги вирішити мультидисциплінарній команді лікарів, зусилля котрої мають бути спрямовані на мінімізування метаболічних змін в організмі за допомогою немедикаментозних заходів і фармакотерапії, спрямованої на відновлення функціональної активності гепатоцитів, нормалізацію ліпідного та вуглеводного обмінів. Оптимальним засобом для покращення функціонального стану печінки у хворих на СХП/МАСГ є SAMe (Гептрал®); із метою покращення вмісту, складу сироваткових ліпідів доцільно застосовувати статини, фенофібрат; для оптимального контролю рівня глікемії слід використовувати агоніст ГПП-1, іНЗКТГ-2.
Переглянути запис вебінару Ви можете за посиланням, перейшовши за посиланням: https://youtu.be/IdT4O6wUXzk?si=eQU7ZXS3sZfsBIjW