Біомаркери при запальних захворюваннях кишківника: практичний посібник. Частина 1
Переклала й адаптувала канд. мед. наук Тетяна Можина
Запальні захворювання кишківника (ЗЗК), серед яких основними є виразковий коліт (ВК) та хвороба Крона, є хронічною імуноопосередкованою патологією, що уражає шлунково-кишковий тракт (ШКТ) [1, 2]. Точна причина виникнення ЗЗК залишається невідомою, але вважається, що вони виникають в осіб із генетичною схильністю, коли тригер довкілля ініціює неадекватну імунну відповідь кишківника [3].
Золотим стандартом оцінювання активності ЗЗК є ендоскопія (колоноскопія) [7], але ця процедура є дорогою, інвазивною з відповідними ризиками для пацієнта. Тому нині для неінвазивного оцінювання активності хвороби, відповіді на лікування, прогнозування рецидиву активно використовують біомаркери. Національний інститут охорони здоров’я визначає біомаркери як «показники, що об’єктивно вимірюються й оцінюються як маркери нормальних біологічних і патологічних процесів або фармакологічних відповідей на терапевтичне втручання» [8].
Біомаркери отримують із різних джерел, включаючи сироватку, сечу, кал або тканини. Хоча кількість біомаркерів, доступних для клініцистів, останніми роками збільшилася, особливо завдяки розвитку метаболоміки, геноміки та протеоміки, не всі біомаркери є корисними або доступними для лікарів у повсякденній практиці [9-12]. Ідеальний біомаркер є чутливим і специфічним до окремої хвороби, доступний без необхідності інвазивного отримання, стосується основної патофізіології, змінюється у відповідь на лікування, корисний для прогнозування, економічно виправданий, прийнятний для пацієнта [13]. Для клініцистів існують важливі додаткові характеристики: доступність, час виконання та надійність аналітичного методу, що використовується.
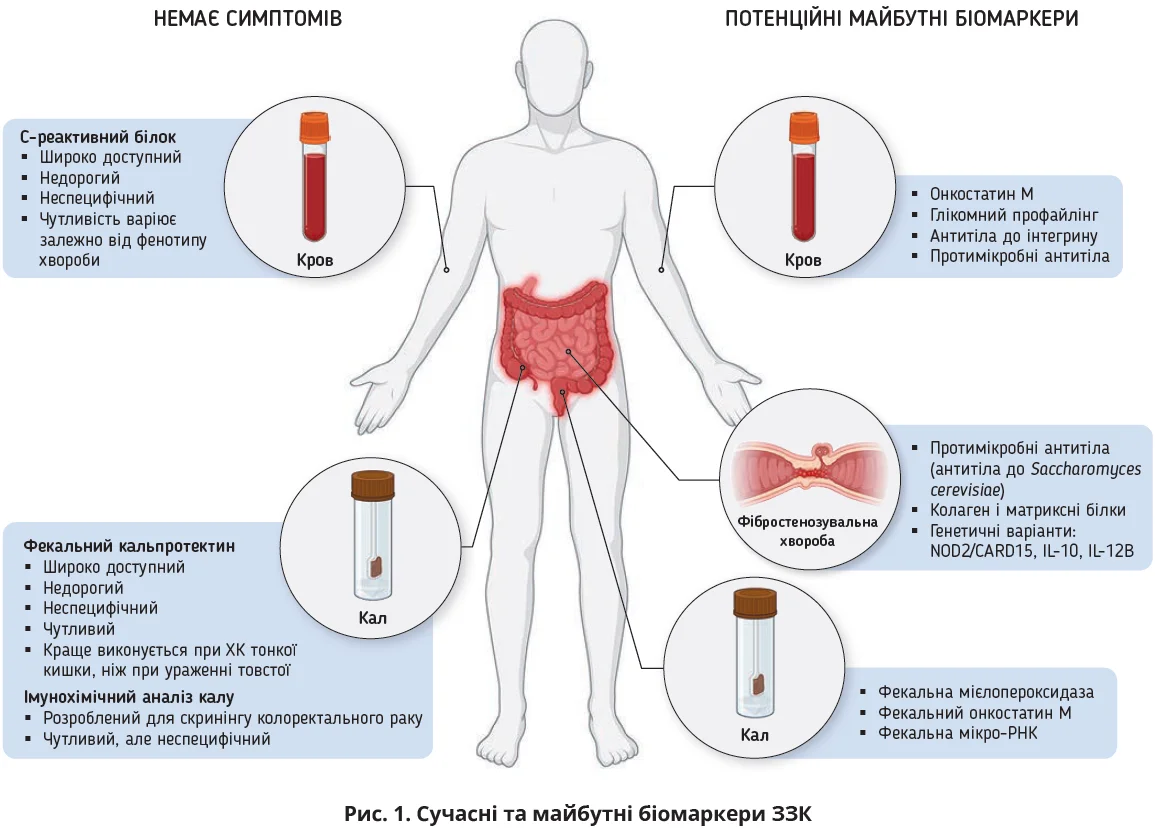
Хоча пошук оптимального біомаркера при ЗЗК триває, в сучасній клінічній практиці найдоступнішими біомаркерами є С-реактивний білок (СРБ) у сироватці крові, а також фекальний кальпротектин (ФКП). Використання інших фекальних маркерів, як-от фекального лактоферину, є менш поширеним. СРБ та ФКП часто використовуються лікарями первинної ланки для диференційної діагностики між ЗЗК та синдромом подразненого кишківника (СПК) [14], а також спеціалістами з лікування ЗЗК для оцінювання симптомів, моніторингу відповіді на терапію.
Усі біомаркери мають індивідуальні переваги й обмеження, їх ефективне клінічне використання потребує ретельної інтерпретації. Ми представляємо оповідальний огляд сучасної літератури з метою створення практичного посібника для лікарів, а також аналізу використання нових біомаркерів ЗЗК у майбутньому.
С-реактивний білок
СРБ та запальна відповідь
Відкритий у 1930-х роках СРБ є пентамерним білком гострої фази, який переважно синтезується в печінці, а також гладкою мускулатурою, лімфоцитами, адипоцитами, макрофагами й ендотеліальними клітинами [18]. У відповідь на інфекційні подразники / пошкодження тканин виробляються цитокіни, включаючи інтерлейкін-6 (ІЛ-6), ІЛ-1β, що призводить до секреції СРБ гепатоцитами в плазму крові. СРБ зв’язується з молекулами C1q, активуючи шлях комплементу, а також з’єднується через Fc-рецептори з IgG, що призводить до вивільнення прозапальних цитокінів [19]. Він також відіграє роль у вродженому імунітеті, зв’язуючись із фосфохоліном, що експресується на поверхні бактерійних клітин, активуючи комплемент-індукований фагоцитоз і апоптоз. Доведено, що циркулювальний СРБ розпадається на мономерні субодиниці, які можуть чинити прозапальну дію завдяки активації моноцитів, ендотеліальних клітин, тромбоцитів і нейтрофілів [20]. Сироваткова концентрація СРБ може збільшуватися в 1000 разів протягом 24-72 годин після впливу деяких бактерійних агентів, але після припинення дії подразника його рівень швидко знижується протягом 18-20 годин [18]. СРБ підвищується при багатьох запальних захворюваннях, у тому числі при ревматоїдному артриті, серцево-судинних захворюваннях, ЗЗК.
СРБ широко доступний для лікарів первинної та вторинної ланок, результати його вимірювання готові протягом декількох хвилин – годин, він прийнятний для пацієнтів та економічно виправданий для оцінювання запалення (рис. 1). СРБ як біомаркер ЗЗК має декілька обмежень через недостатню специфічність, оскільки його експресія значно зростає при численних інфекційних/запальних захворюваннях, що обмежує його корисність у диференційній діагностиці ЗЗК й інших патологій. У разі ЗЗК СРБ переважно використовують як доповнення до результатів клінічних та ендоскопічних обстежень.
СРБ у діагностиці ЗЗК
СРБ часто використовується на етапі первинної медичної допомоги для скринінгу запальної патології; щодо скарг із боку ШКТ: він допомагає розрізнити запальні й функціональні хвороби [21]. Однак огляд показав, що ≈25% пацієнтів з активною ХК не мають відповідних змін СРБ, а ранні дослідження, проведені в лікарні St. Mark’s Hospital (Велика Британія), виявили, що підвищений рівень СРБ мають лише 50% пацієнтів із ВК [22]. Генетичний поліморфізм вважають джерелом варіабельності СРБ у різних пацієнтів [23]. Отже, виключення ЗЗК не має ґрунтуватися лише на нормальному рівні СРБ, а поєднуватися з клінічними даними, значенням інших маркерів із кращою чутливістю.
СРБ у моніторингу хвороби
В осіб із підтвердженим діагнозом ЗЗК СРБ широко використовують як неінвазивний маркер для оцінювання активності хвороби. Однак його точність залежить від багатьох клінічних чинників, у тому числі від того, страждає пацієнт на ВК або ХК, а також тривалості хвороби [24, 25]. Кореляція між активністю захворювання та СРБ сильніша при ХК, ніж у разі ВК [26]; однак вона залежить від тяжкості й локалізації хвороби.
СРБ має вирішальну роль в оцінюванні тяжкості перебігу гострого ВК (ГВК) разом із клінічними, рентгенологічними й ендоскопічними даними. Настанова Європейської організації з вивчення ХК та коліту (ECCO) стверджує, що значне підвищення рівня СРБ >30 мг/л разом із кров’янистою діареєю, частотою випорожнень >6 разів на добу свідчить про ГВК; такі пацієнти потребують госпіталізації для інтенсивного лікування внутрішньовенними стероїдами, інфліксимабом або циклоспорином [32].
Співвідношення СРБ до індексу альбуміну (СІА) визначене як корисний біомаркер у разі ГВК; СІА >0,85 на 3-й день госпіталізації прогнозує стероїдорезистентний ГВК та необхідність призначення рятувальної терапії [36]. Значення СІА >0,37 під час виписки в пацієнтів, які відповіли на лікування, свідчило про високу ймовірність проведення колектомії протягом 12 місяців [37]. Отже, СРБ залишається ключовою частиною загальної клінічної оцінки, прийняття рішень щодо ескалації лікування та необхідності хірургічного втручання при ГВК.
СРБ в оцінюванні відповіді на лікування
Значна частина пацієнтів із ХК не мають підвищеного рівня СРБ, незважаючи на клініко-ендоскопічну активність хвороби, тому СРБ не є корисним інструментом моніторингу в цих пацієнтів. Загалом стійко підвищений рівень СРБ асоціюється з неефективністю терапії [38, 39], тоді як його зниження корелює з клінічною відповіддю [40, 41].
Доведено, що навіть у безсимптомних пацієнтів персистування підвищеного рівня СРБ асоціюється з вищою частотою госпіталізації [28]. Персистивний СРБ може бути індикатором необхідності подальшого обстеження та перегляду лікування у хворих на ХК.
СРБ у прогнозуванні післяопераційних рецидивів
Існують суперечливі дані щодо здатності СРБ прогнозувати післяопераційний рецидив у разі ХК.
Дослідження, проведене в невеликій когорті (n=12), довело, що стійке підвищення рівня СРБ асоціюється з післяопераційним рецидивом [45]. Персистивний СРБ може просто відображати агресивніший і тяжчий перебіг хвороби, що, як відомо, є чинником ризику післяопераційного рецидиву.
Фекальний кальпротектин
Структура та функції ФКП
Уперше виявлений у 1980-х роках ФКП є неінвазивним фекальним біомаркером, який дає змогу виявити запалення кишківника [47, 48]. Кальпротектин (КП) є частиною висококонсервативного сімейства кальцієзв’язувальних білків S100 лейкоцитів, що складається з двох мономерів – S100A8 та S100A9 [49]. Мономери можуть утворювати гетеродимери й тетрамери кальцієзалежним чином, причому кожен гетеродимер має сайти зв’язування з перехідними металами [50]. КП у великій кількості міститься в цитозолі нейтрофілів і експресується моноцитами, дендритними клітинами, активованими макрофагами та пласким епітелієм слизової оболонки [47]. Під час запалення експресія КП індукується бактерійними ліпополісахаридами, фактором некрозу пухлин-α й ІЛ-1β [51, 52].
ФКП у діагностиці ЗЗК
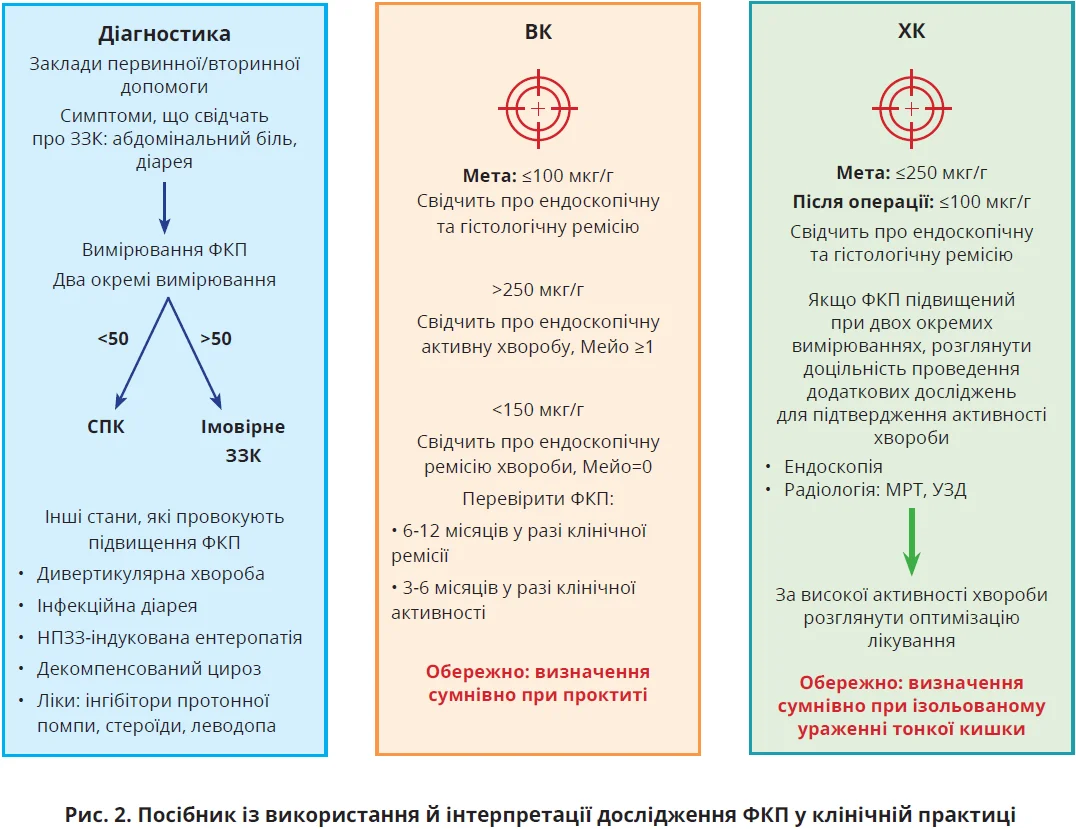
Дослідження на здорових людях установили нормативні значення ФКП у діапазоні 10-50 мкг/г, хоча цей показник дещо варіює залежно від досліджуваної популяції та використаного аналізу [59, 60]. Із розвитком можливостей виявлення ФКП цей показник став першим фекальним біомаркером, за допомогою якого запальні хвороби ШКТ відрізняють від незапальних [21, 61]. Визначення ФКП є недорогим, широко доступним методом дослідження для закладів первинної та вторинної медичної допомоги; сам ФКП залишається стабільним за кімнатної температури в калі щонайменше 3 дні, що зменшує складності обробки та транспортування зразків (рис. 2) [62].
ФКП корелює з кількістю нейтрофілів у просвіті кишківника, втім, хоча є чутливим у виявленні запалення кишківника, не здатний розрізнити етіологію запалення. ФКП підвищується при інфекційному гастроентериті та корелює з тяжкістю хвороби при сальмонельозі, Campylobacter, Clostridia [63-65]. Підвищені рівні ФКП можуть спостерігатися при злоякісних пухлинах товстої кишки [66], дивертикулярній хворобі [67], некротичному ентероколіті [68], хворобі «трансплантат проти хазяїна» [69], ентеропатії, спричиненій нестероїдними протизапальними засобами (НПЗЗ) [70]. Високий рівень ФКП може спостерігатися при некишковій патології (декомпенсований цироз печінки [71], пневмонія [72]), імовірно, внаслідок зміни кишкової мікробіоти та бактерійної транслокації.
Незважаючи на недостатню специфічність, ФКП корисний для виключення широкого спектра ЗЗК. Це робить його особливо корисним для первинної медичної допомоги, де тестування ФКП рекомендовано національними настановами для диференційної діагностики між СПК та ЗЗК [73]. Рівень ФКП >50 мкг/г у двох випадках вважається підставою для подальшого інвазивного обстеження за допомогою колоноскопії; нещодавній метааналіз установив сукупну чутливість і специфічність ФКП у діагностиці ЗЗК при цьому пороговому значенні, які становили, відповідно, 85,8 та 91,7% [74]. Вищі рівні (>250 мкг/г) можуть указувати на активне запалення кишківника [75]; однак інтерпретацію дещо підвищеного вмісту ФКП треба проводити обережно через здатність різних препаратів (інгібітори протонної помпи [77], НПЗЗ [70], глюкокортикоїди [78], леводопа [79]) індукувати експресію КП.
ФКП у моніторингу хвороби
ФКП корелює з ендоскопічною активністю ЗЗК, особливо на тлі запалення товстої кишки; низькі рівні спостерігаються в пацієнтів з ендоскопічною та гістологічною ремісією [80, 81]. ФКП перевершує СРБ у прогнозуванні ендоскопічної активності хвороби [82], дедалі частіше використовується в пацієнтів із клінічною ремісією для прогнозування рецидиву хвороби, моніторингу відповіді на терапію при активному захворюванні. Дослідження «Вплив жорсткого контролю лікування ХК» продемонструвало, що підхід «лікувати до досягнення мети», заснований на результатах ФКП, є кращим за підвищення активності лікування лише з огляду на симптоми [83]. Міжнародна організація з вивчення ЗЗК опублікувала рекомендації в рамках консенсусу «Вибір терапевтичних мішеней у разі ЗЗК», згідно з яким метою лікування є цільовий показник ФКП <150 мкг/г [7].
ФКП >150 мкг/г може прогнозувати післяопераційний рецидив ХК з чутливістю ≈70% [88], хоча сучасні настанови рекомендують проведення колоноскопії через 6 місяців після операції для візуалізації анастомозу та розрахунку прогностичного бала (шкала Rutgeerts) для визначення подальшого лікування. ФКП є вірогідним методом оцінювання активності хвороби у вагітних із ЗЗК [89]. Багато клініцистів використовують як СРБ, так і ФКП для оцінювання активності ЗЗК у рутинній клінічній практиці. Дослідження підтверджують, що поєднання доступних біомаркерів є ефективною стратегією моніторингу хвороби, оскільки підвищення СРБ та ФКП краще прогнозують результати лікування інфліксимабом, аніж використання лише одного з цих маркерів [84, 90].
Імунохімічний аналіз калу
Імунохімічний аналіз калу (ІАК) вимірює вміст гемоглобіну в калі за допомогою специфічних антитіл; він широко використовується на етапі первинної медичної допомоги для прогнозування ризику розвитку колоректального раку та необхідності проведення ендоскопічного обстеження [105, 106]. ІАК чутливо виявляє запалення слизової оболонки та приховану внутрішньопорожнинну крововтрату, що розкриває його роль як потенційного біомаркера при ЗЗК [107-109]. Проспективне дослідження продемонструвало, що одночасний рівень ІАК <100 нг/мл і ФКП <250 мкг/г є сильним прогностичним чинником загоєння слизової оболонки; кращі показники зафіксовано при ВК, ніж у разі ХК [110].
Як у випадку з ФКП, обмеженням ІАК є його недостатня специфічність, оскільки підвищення значень ІАК також спостерігається при системних запальних захворюваннях та інших запальних патологіях ШКТ, колоректальному раку [112].
ІАК не є ефективним дослідженням для виявлення ХК тонкої кишки порівняно із ЗЗК товстої кишки [110]. ІАК застосовується для виявлення колоректальних злоякісних неоплазій, він є менш чутливим маркером для виявлення правобічних уражень товстої кишки [113].
Література
Clough J., et al. Biomarkers in inflammatory bowel disease: a practical guide. Ther. Adv. Gastroenterol. 2024 May 9; 17. doi: 10.1177/17562848241251600.