Клінічна ефективність фекальних маркерів для оцінювання активності запальних захворювань кишківника та колоректальних пухлин
Підготувала канд. біол. наук Олександра Демецька
Запальні захворювання кишківника (ЗЗК) є поширеними та дорогими з погляду затрат на лікування станами. Вони характеризуються повторюваними епізодами запалення шлунково-кишкового тракту (ШКТ), можуть мати чимало позакишкових проявів і підвищують ризик розвитку колоректального раку (КРР). Використання неінвазивних фекальних маркерів може бути доцільним не тільки для індикації запалення кишківника в таких пацієнтів, а й для оцінювання прогресивних новоутворень і КРР.
Запальні хвороби кишківника: епідеміологія та патогенез
ЗЗК представлені виразковим колітом (ВК) і хворобою Крона (ХК). Їх поширеність наближається до 1% у західному світі та постійно зростає в країнах з різним рівнем доходів [1]. Хоча здебільшого ЗЗК виявляються в людей віком від 15 до 30 років, у підлітковому віці їх поширеність може становити близько 25%, тоді як після 60 років – близько 15% [2].
Незважаючи на те що аналіз геному пацієнтів із ЗЗК розгадав численні шляхи, залучені до їх патогенезу, генетичні дослідження пояснили лише частину спадковості ЗЗК. Чинники довкілля також відіграють важливу роль у запаленні кишківника, головним чином через їхній вплив на склад мікробіому. Однак для того, щоб мікробний дисбактеріоз спричинив неконтрольоване запалення кишківника, також має бути порушено кишковий бар’єр, утворений епітеліальними клітинами кишківника та вродженою імунною системою. Нарешті, активація імунної системи залежить від робочого балансу між ефекторними та регуляторними клітинами, присутніми в слизовій оболонці кишківника, які також були виявлені нерегульованими в цій групі пацієнтів. Отже, патогенез ЗЗК є результатом взаємодії генетичної сприйнятливості та впливу довкілля на мікробіом, що через ослаблення кишкового бар’єра призводить до невідповідної імунної активації кишківника.
ЗЗК характеризуються повторюваними епізодами запалення ШКТ, спричиненими аномальною імунною відповіддю на кишкову мікрофлору. Вони охоплюють два типи ідіопатичних хвороб кишківника, які диференціюються за місцем розташування та глибиною ураження його стінки. Зокрема, ВК включає дифузне запалення слизової оболонки товстої кишки. Найчастіше він уражає пряму кишку (проктит), але може поширюватися на сигмоподібну кишку (проктосигмоїдит), за межі сигмоподібної кишки (дистальний ВК) або охоплювати всю товсту кишку аж до сліпої кишки (панколіт).
Своєю чергою, ХК призводить до трансмуральної виразки будь-якої частини ШКТ, найчастіше вражаючи термінальний відділ клубової та товстої кишок. Обидві хвороби класифікуються за ступенем (легкий, середній або тяжкий) і локалізацією.
ХК також класифікується за фенотипом: запальний, стриктурний або проникний.
Окрім впливу на ШКТ, як ХК, так і ВК мають багато позакишкових проявів, а також підвищують ризик розвитку КРР [3, 4].
Діагностика й оцінювання відповіді на лікування
Ендоскопічна оцінка ЗЗК залишається золотим стандартом діагностики, оцінювання відповіді на лікування та визначення післяопераційного рецидиву, але є дорогою й інвазивною.
Фекальний імунологічний аналіз (ФІА) є стандартним методом скринінгу для виявлення КРР.
Незважаючи на високу специфічність (88-97,7%), його чутливість недостатня для скринінгу онкопатології. Зокрема, тестування ФІА протягом 2 днів поспіль рекомендується для компенсації низької чутливості, оскільки ФІА може спричинити хибнонегативні результати через неправильне зберігання калу та зниження чутливості через деградацію гемоглобіну (Гб) під час тривалої затримки в кишківнику [5].
Доступні біомаркери можуть полегшити неінвазивне оцінювання хвороби та підвищити ефективність скринінгу онкопатології. Зокрема, неінвазивні фекальні маркери нещодавно використовувалися як індикатори запалення кишківника в пацієнтів із ЗЗК. Тому певний інтерес становило вивчення їхньої ефективності не тільки щодо оцінювання активності ЗЗК, а й щодо злоякісних новоутворень.
Клінічне валідаційне дослідження вимірювання фекальних рівнів кальпротектину, лактоферину та гемоглобіну
Було проведено клінічне валідаційне дослідження для вимірювання фекальних рівнів кальпротектину (Кп), лактоферину (Лф) і Гб за допомогою набору «все в одному» в пацієнтів із ЗЗК та колоректальними пухлинами [5]. Воно мало на меті підтвердити корисність фекальних рівнів Кп, Лф і Гб шляхом одночасного вимірювання в пацієнтів із ЗЗК та колоректальними пухлинами.
Це проспективне одноцентрове обсерваційне дослідження було проведено в лікарні медичного університету Саппоро (Японія). Однією з основних кінцевих точок було підтвердження клінічної ефективності фекальних Кп, Лф і Гб у виявленні клінічної ремісії в пацієнтів із ЗЗК.
Іншою первинною кінцевою точкою було визначення граничних значень цих фекальних маркерів для виявлення КРР і прогресивних новоутворень у пацієнтів без ЗЗК.
Загалом 120 пацієнтів, які пройшли колоноскопію в лікарні університету, взяли участь у дослідженні в період із березня 2020 року по березень 2022 року, в тому числі 29 пацієнтів з ВК, 25 – з ХК, 48 – з колоректальними пухлинами та 18 здорових осіб із групи контролю (без колоректальної аденоми або раку при колоноскопії та супутніх системних запальних хвороб, які можуть вплинути на результати фекальних маркерів).
Усі зареєстровані пацієнти пройшли колоноскопію та забір калу, а кожне захворювання було діагностовано на підставі клінічних, ендоскопічних і гістопатологічних результатів. Було виключено 11 осіб, які зазнали втручання між ендоскопією й забором калу в групах ВК та ХК, 4 із супутніми хворобами, що спричинили системне запалення, й 1 пацієнта з групи контролю зі злоякісним новоутворенням тонкої кишки. Зрештою було проаналізовано дані 104 пацієнтів.
Усі учасники надали один зразок калу протягом 72 годин після збору. Фекальні рівні Кп, Лф і Гб вимірювали за допомогою автоматизованого імунохімічного аналізатора для дослідження калу Hemotect NS-Prime, який може вимірювати ці фекальні маркери одночасно з колоїдним золотом за допомогою імунохроматографічного аналізу. Період між ендоскопією та збором калу був обмежений 1 роком.
Діагностика колоректальної пухлини й оцінювання клінічної та ендоскопічної тяжкості ЗЗК
Із 48 пацієнтів з колоректальними пухлинами при колоноскопії 14 мали інвазивні раки, які були діагностовані за результатами патологоанатомічних знахідок після хірургічної резекції. Пацієнтам,
у яких первинна пухлина не була видалена, глибину інвазії оцінювали за результатами ендоскопічного дослідження, комп’ютерної та магнітно-резонансної томографії.
Ендоскопічний ступінь тяжкості оцінювався відповідно до ендоскопічного субіндексу Мейо й ендоскопічного індексу тяжкості ВК для неспецифічного ВК і простого ендоскопічного бала при ХК для ХК. Було досліджено зв’язок між рівнями фекальних маркерів і клінічними й ендоскопічними балами активності хвороби як у групі ВК, так і в групі ХК.
Фекальні рівні кальпротектину, лактоферину та гемоглобіну
Понад половина пацієнтів із клінічно активним ЗЗК (15 із ВК та 10 із ХК) пройшли колоноскопію за 2 тижні до моменту взяття зразків калу, а більшість із цих 25 пацієнтів із ЗЗК пройшли колоноскопію протягом приблизно місяця до та після взяття зразків калу. Рівні Кп у фекаліях у пацієнтів з ВК, ХК, інвазивним КРР, колоректальними аденомами та з групи контролю становили 43-30 242 мкг/г, 260-7232 мкг/г, 42-7488 мкг/г, 28-1536 мкг/г і 37-308 мкг/г відповідно. Рівні Кп у фекаліях були значно вищими в пацієнтів з ВК та ХК, ніж у групі контролю (p<0,01).
Рівні Лф у фекаліях пацієнтів з ВК, ХК, інвазивним КРР, колоректальними аденомами та в групі контролю становили 9-12 023 мкг/г, 38-5456 мкг/г, 12-2106 мкг/г, 9-779 мкг/г і 2-85 мкг/г відповідно. Рівні фекального Лф були значно вищими в пацієнтів з ВК і ХК, ніж у пацієнтів з колоректальними аденомами (p=0,03), а також осіб із групи контролю (p<0,01).
Рівні Гб у калі в пацієнтів з неспецифічним ВК, ХК, інвазивним КРР, колоректальною аденомою та в групі контролю становили 3-12 302 нг/мл, 2-23 623 нг/мл, 9-76 404 нг/мл, 2-902 нг/мл і 0-28 нг/мл відповідно. Рівні Гб у калі були значно вищими в пацієнтів з КРР, аніж у пацієнтів з ХК (p=0,03), колоректальною аденомою (p<0,01) або в групі контролю (p<0,01). Крім того, фекальні рівні Гб були значно вищими в пацієнтів з ВК, ніж у пацієнтів контрольної групи (p<0,01).
Кореляція між фекальними маркерами та клінічною оцінкою
Часткова оцінка Мейо корелювала з фекальними Кп (p<0,01), Лф (p<0,01) і Гб (p<0,05). Простий бал індексу активності ХК істотно корелював лише з фекальним Гб (p=0,043) і не показав кореляції з Кп або Лф.
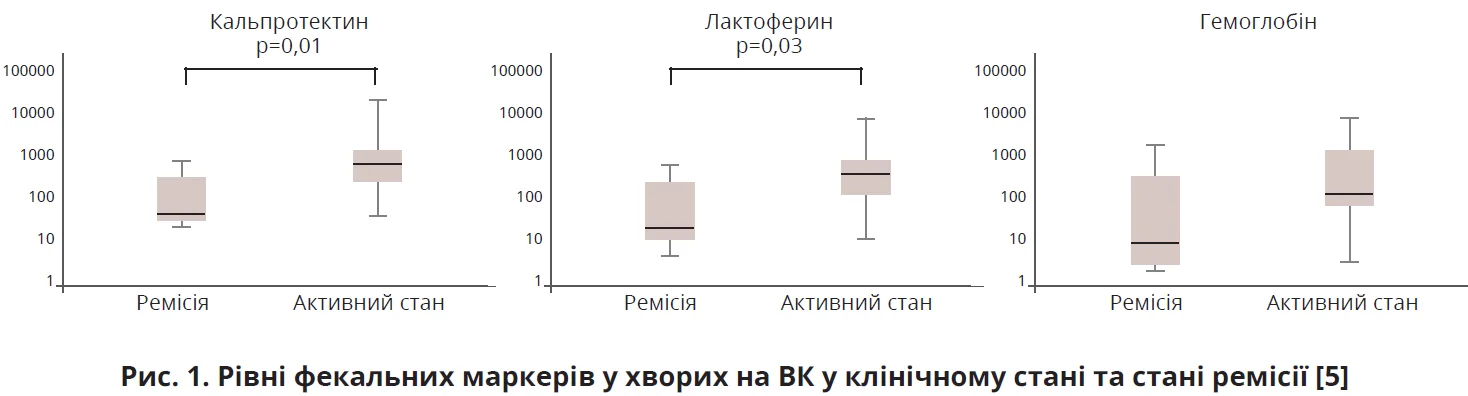
Щодо активності захворювання на неспецифічний ВК, то фекальні Кп і Лф були значно вищими в пацієнтів з активною хворобою, ніж у пацієнтів у клінічній ремісії (p=0,01 і p=0,03 відповідно); однак не було істотної різниці в рівнях Гб у калі (рис. 1).
Фекальний Кп 164 мкг/г (чутливість – 93%, специфічність – 63%) і Лф 85 мкг/г (чутливість – 87%, специфічність – 63%) були найкращими дискримінаційними рівнями для прогнозування активного стану при ЗЗК. Однак жоден з фекальних маркерів не продемонстрував істотної різниці між станом активної та клінічної ремісії в групі ХК.
Зв’язок між фекальними маркерами та колоректальною пухлиною
Для оцінювання здатності фекальних маркерів виявляти поширену неоплазію та КРР було порівняно рівні маркерів калу в пацієнтів з КРР і аденомою з аналогічними показниками в пацієнтів групи контролю.
Рівні Гб у калі були значно вищими в пацієнтів з КРР, аніж у пацієнтів з аденомою (p=0,004) і в групі контролю (p=0,019) (рис. 2). Хоча фекальні Кп і Лф у пацієнтів з колоректальними пухлинами зазвичай були вищими, ніж у контрольній групі, не було істотних відмінностей у фекальних Кп і Лф між трьома групами (рис. 2).
Лише фекальний Гб мав найкращі чутливість (78,6%), специфічність (85,1%), позитивну прогностичну цінність (61,1%) і негативну прогностичну цінність (93%) для виявлення КРР (p<0,001). В аналізі для виявлення прогресивної аденоми та КРР фекальний Гб мав найкращі специфічність (87,5%) і позитивну прогностичну цінність (79,5%);
при цьому додавання Кп та Лф збільшило чутливість і негативну прогностичну цінність.
Зв’язок між фекальними маркерами й розміром пухлини та глибиною інвазії при КРР
Середній максимальний діаметр колоректальних пухлин, за винятком карциноми, становив 6,5 мм (діапазон – 2-18 мм). Хоча було досліджено зв’язок між розміром поліпа та фекальними маркерами, суттєвої кореляції не спостерігалося. При КРР фекальні маркери істотно не відрізнялися залежно від локалізації ураження, проте підвищені фекальні Кп і Лф можуть бути пов’язані з прогресуванням КРР.
Висновки
Очікується, що фекальні біомаркери стануть неінвазивною альтернативою колоноскопії. Фекальні рівні Кп і Лф можна використовувати як еквівалентні біомаркери для оцінювання клінічної активності в пацієнтів з ВК. Установлено, що їхні рівні є підвищеними в пацієнтів із клінічно активним ВК та колоректальними пухлинами. Фекальний Гб є найкориснішим маркером для скринінгу КРР, при цьому додавання фекальних Кп і Лф може компенсувати низьку чутливість виявлення прогресивних новоутворень за допомогою лише Гб.
Література
- Clough J., Colwill M., Poullis A., et al. Biomarkers in inflammatory bowel disease: a practical guide. Therap. Adv. Gastroenterol. 2024; 17: 17562848241251600. doi: 10.1177/17562848241251600.
- Su H.J., Chiu Y.T., Chiu C.T., et al. Inflammatory bowel disease and its treatment in 2018: Global and Taiwanese status updates. J. Formos. Med. Assoc. 2019; 118 (7): 1083-1092.
- Dmochowska N., Wardill H.R., Hughes P.A. Advances in imaging specific mediators of inflammatory bowel disease. Int. J. Mol. Sci. 2018 Aug; 19 (9): 2471. doi: 10.3390/ijms19092471.
- Colombel J.F., Shin A., Gibson P.R. AGA clinical practice update on functional gastrointestinal symptoms in patients with inflammatory bowel disease: expert review. Clin. Gastroenterol. Hepatol. 2019; 17 (3): 380-390.e1. doi: 10.1016/j.cgh.2018.08.001.
- Yamakawa T., Miyake T., Yokoyama Y., et al. Clinical performance of fecal calprotectin, lactoferrin, and hemoglobin for evaluating the disease activity of IBD and detecting colorectal tumors. JGH Open. 2024; 8 (6): e13077. doi: 10.1002/jgh3.13077.